2026年1月21日,美國約翰霍普金斯大學Erika L. Pearce、Daniel J. Puleston團隊,在國際期刊Nature發表了題為“The transition from monocyte to tissue-resident macrophage requires DHPS"的研究性論文。該研究表明,deoxyhypusine synthase(DHPS),一種介導依賴精胺的 eIF5A 翻譯因子hypusine 修飾的酶,對組織定居巨噬細胞(Tissue-resident macrophages:RTM) 的分化和維持是必需的。

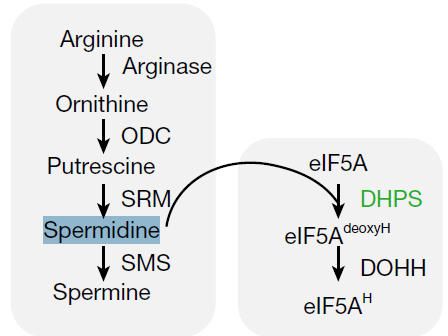
多胺(Polyamines)是一類含有兩個或多個氨基的脂肪族含氮化合物,主要包括以下三種:?腐胺?(Putrescine, Put),?亞精胺?(Spermidine, Spd),?精胺?(Spermine, Spm)。其生物合成以鳥氨酸和精氨酸為前體,通過鳥氨酸脫羧酶與精氨酸脫羧酶催化生成腐胺,后續經氨丙基轉移形成亞精胺和精胺。多胺通過正電荷氨基與核酸結合參與
亞精胺(Spermidine),是顯微鏡之父的列文虎克于1678年在觀察精液(Sperm)樣本的過程中發現。200年后被德國科學家Ladanburg正式命名Spermidine。亞精胺(Spermidine)是真核翻譯起始因子5A (eIF5A)保守賴氨酸(K50)殘基羥丁賴氨酸修飾(hypusination)的關鍵前體。Hypusine于1971年First從牛腦提取物中分離出來。Hypusine是真核翻譯起始因子5A (eIF5A)賴氨酸殘基通過脫氧hypusine合酶(DHPS) 和脫氧hypusine羥化酶(DOHH) 的酶促反應生成的。elF5A是目前已知的在保守賴氨酸殘基處進行翻譯后修飾生成Hypusine的only蛋白。
多胺生物合成與eIF5a羥脯氨酸化途徑
?羥腐胺賴氨酸化?(Hypusination)是一種獨特且保守的翻譯后修飾,主要發生在真核生物翻譯起始因子5A(eIF5A)的一個特定賴氨酸殘基上。這一過程對于eIF5A的功能激活至關重要,并在多種細胞生理和病理過程中扮演關鍵角色。

Hypusination是一個兩步酶促反應:
首先:由?脫氧hypusine合成酶?(DHPS)催化,將多胺?亞精胺?(spermidine)的氨基丁基部分轉移至eIF5A前體蛋白的賴氨酸殘基(Lys50)上,形成中間體。
然后:由?脫氧hypusine羥化酶?(DOHH)催化,對中間體進行羥化,最終形成成熟的?hypusine?(Nε-[4-氨基-2-羥基丁基]-賴氨酸)修飾。?
Hypusination修飾的eIF5A(hypusinated eIF5A)并非直接參與翻譯起始,而是作為?核糖體啟動器,特別有助于解決mRNA翻譯過程中因多聚脯氨酸序列(PPT)等結構導致的?核糖體停滯?,從而促進特定蛋白質的高效合成。?