2026年1月21日,美國約翰霍普金斯大學Erika L. Pearce、Daniel J. Puleston團隊,在國際期刊Nature(IF:69.504)發表了題為“The transition from monocyte to tissue-resident macrophage requires DHPS"的研究性論文。該研究證實,脫氧羥腐胺合成酶(Deoxyhypusine synthase:DHPS)是單核細胞向組織駐留巨噬細胞(Tissue-resident macrophage:RTM)分化及維持所必需的關鍵酶。DHPS介導了翻譯起始因子5A(eukaryotic translation initiation factor 5A:eIF5A)的亞精胺(Spermidine)依賴性羥腐胺修飾(hypusination)。在髓系細胞特異性敲除DHPS的小鼠(Dhps-ΔM小鼠)中,研究者觀察到跨多種組織:包括腹膜、肺、肝、心臟、腦、脾臟和腎臟的成熟RTM存在全局性缺陷。這些組織中盡管存在F4/80陽性的巨噬細胞,但缺乏TIM-4、Siglec-F、CX3CR1等標志性RTM亞群。這種缺陷并非由于巨噬細胞缺失,而是表現為向成熟RTM表型分化的阻滯。從而系統的揭示了脫氧羥腐胺合成酶(deoxyhypusine synthase, DHPS)在單核細胞向組織駐留巨噬細胞(RTM)分化及其穩態維持中的核心調控作用。

組織駐留巨噬細胞(RTM)幾乎存在于機體所有組織,其大多數在胚胎發育初期已經定植,其分化過程及長期組織駐留依賴特定的分子網絡調控機制。正常狀況下,通過局部自我更新,并通過清除死亡細胞和碎片來調節組織穩態。但是,在組織損傷應激時,骨髓來源的單核細胞進入組織并分化為RTM,以修復組織并補充生態位中的巨噬細胞。控制單核細胞向RTM轉變以及跨多個不同組織成熟RTM維持的普適性細胞內在機制尚不清楚。該研究正是試圖找到單核細胞向組織駐留巨噬細胞轉變的開關。
多胺(Polyamines)是一類含有兩個或多個氨基的脂肪族含氮化合物,主要包括以下三種:?腐胺?(Putrescine, Put),?亞精胺?(Spermidine, Spd),?精胺?(Spermine, Spm)。其生物合成以鳥氨酸和精氨酸為前體,通過鳥氨酸脫羧酶與精氨酸脫羧酶催化生成腐胺,后續經氨丙基轉移形成亞精胺和精胺。
亞精胺(Spermidine),是顯微鏡之父的列文虎克于1678年在觀察精液(Sperm)樣本的過程中發現。200年后被德國科學家Ladanburg正式命名Spermidine。亞精胺(Spermidine)是真核翻譯起始因子5A (eIF5A)保守賴氨酸(K50)殘基羥丁賴氨酸修飾(hypusination)的關鍵前體。Hypusine于1971年First從牛腦提取物中分離出來。Hypusine是真核翻譯起始因子5A (eIF5A)賴氨酸殘基通過脫氧hypusine合酶(DHPS) 和脫氧hypusine羥化酶(DOHH) 的酶促反應生成的。elF5A是目前已知的在保守賴氨酸殘基處進行翻譯后修飾生成Hypusine的only蛋白。
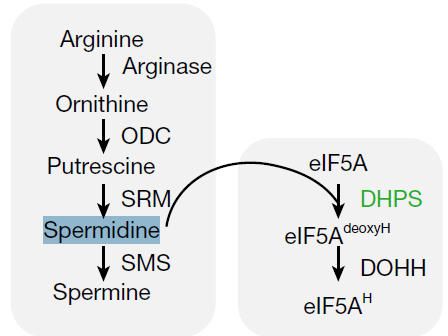
多胺生物合成與eIF5a羥脯氨酸化途徑
研究人員首先構建了LysM-Cre介導的髓系特異性Dhps基因敲除小鼠(Dhps-ΔM),實現單核細胞及巨噬細胞譜系中DHPS蛋白的條件性缺失。聯合Rosa26-YFP報告系統與CX3CR1-CreERT2誘導型重組系統,通過他莫昔芬誘導實現時空特異性基因敲除,并示蹤單核細胞來源巨噬細胞的譜系命運。采用流式細胞術定量分析腹腔、肺、肝、心、腦、脾、腎等組織中巨噬細胞亞群的分布,評估DHPS缺失對組織駐留巨噬細胞(tissue-resident macrophage, RTM)穩態的影響。
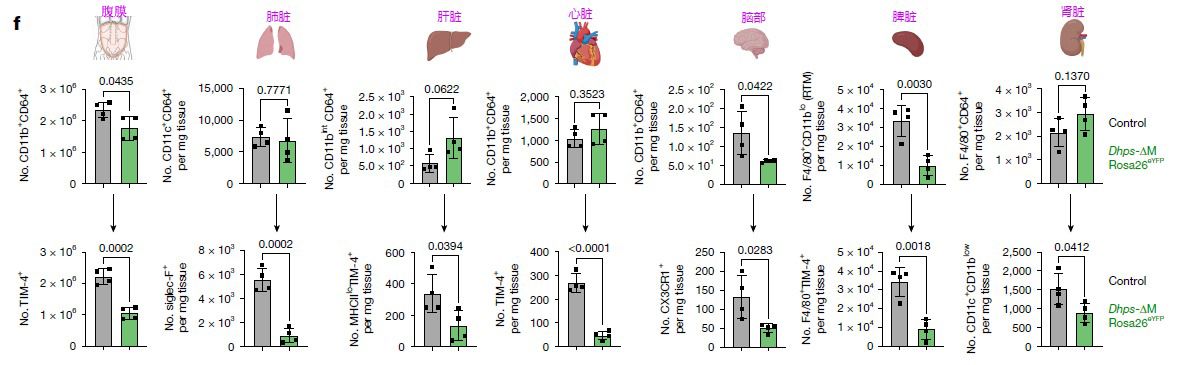
DHPS缺失導致全身性組織駐留巨噬細胞(RTM)數量顯著減少
研究人員尋找DHPS缺失導致全身性組織駐留巨噬細胞(RTM)數量顯著減少的原因。發現DHPS缺失的巨噬細胞中Ki67?細胞比例顯著降低,同時cleaved caspase-3蛋白表達水平升高,這表明細胞周期進程受抑且凋亡活性增強;在IL-4刺激條件下,DHPS缺失巨噬細胞的增殖反應顯著減弱,表現為細胞數量擴增幅度及Ki67?比例均低于野生型對照。此外,骨髓嵌合體實驗顯示,Dhps-ΔM 小鼠中的 RTM 缺陷源于巨噬細胞在組織中的存活能力差,從而導致持續的單核細胞涌入。進一步,研究人員使用荷蘭Liposoma的巨噬細胞清除劑ClodronateLiposomes(CL,貨號C-005)“騰籠換鳥",即向小鼠氣管注射了氯膦酸脂質體(CL)以清除肺臟組織駐留巨噬細胞(RTM):肺泡巨噬細胞(AM),騰出生態位(Niche),為了捕捉急性巨噬細胞清除后 RTM生態變化。在對照小鼠中,CL 導致巨噬細胞迅速耗竭,隨后單核細胞被招募并隨時間分化為 SIGLEC-F CD11b^low 肺泡巨噬細胞。然而在 Dhps-ΔM 小鼠中,單核細胞進入并分化為持續存在的 CD64 CD11c^+ 巨噬細胞群體,但未能重新建立局部 SIGLEC-F CD11b^low 肺 RTM 儲備。另外還可見 CD11b Ly6c^+ 單核細胞持續涌入。進一步在腹膜中驗證肺臟的發現,在對照小鼠中,腹腔注射(i.p.)CL 迅速耗竭腹膜巨噬細胞,隨后單核細胞被招募并分化為巨噬細胞。然而在 Dhps-ΔM 小鼠中,CL 處理后單核細胞在組織中持續存在,但未能重新建立局部 RTM 群體。總體來看,這些數據表明,DHPS 缺失的多種 RTM 群體的組織駐留潛力崩潰,導致持續但終究徒勞的單核細胞浸潤以恢復 RTM 儲備。
進一步的研究發現,成熟的RTM自身的持續生存也依賴于DHPS。利用CX3CR1–ERT2cre誘導性敲除系統在成年小鼠中急性刪除成熟腎臟RTM、心臟RTM和小膠質細胞中的DHPS,會導致這些已建立的RTM群體數量逐漸減少,并伴隨caspase-3活性增加,表明其生存能力受損。DHPS缺失導致的RTM分化阻滯和功能失常直接影響了組織的穩態維持。DHPS缺失的肺泡巨噬細胞清除表面活性物質的能力受損,導致小鼠隨著周齡增長出現肺泡蛋白沉積癥,并伴有肺部免疫細胞浸潤增加。體外和體內實驗均顯示,DHPS缺失的巨噬細胞對凋亡細胞和應激紅細胞的清除能力(efferocytosis)下降。在肝臟中,研究人員使用荷蘭Liposoma的ClodronateLiposomes巨噬細胞清除劑急性耗竭巨噬細胞后,DHPS缺陷小鼠表現出更嚴重的組織病理學損傷,包括充血、竇狀隙異常、內皮剝離及廣泛壞死,提示其組織穩態修復能力嚴重受損。

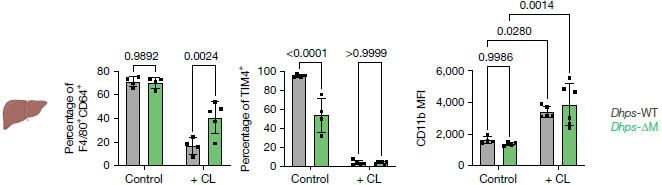
腹腔注射Liposoma的巨噬細胞清除劑CL快速有效的清除肝臟RTM
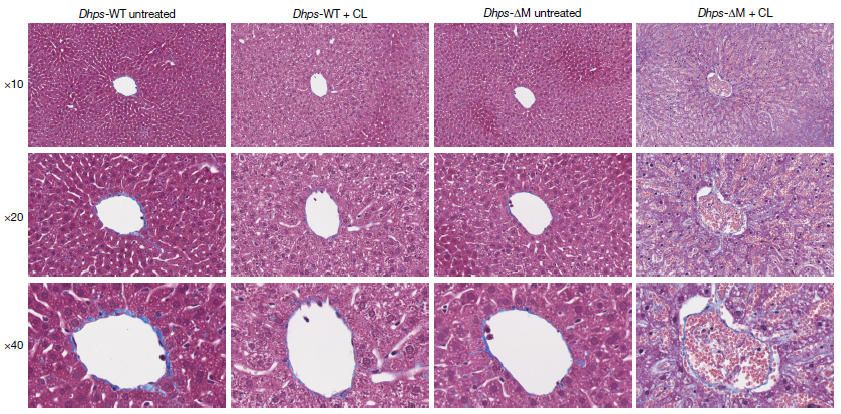
CL急性清除RTM后,DHPS缺陷小鼠的肝臟表現出更嚴重的組織病理學損傷,提示其組織穩態修復能力嚴重受損
總之,該研究證實,即單核細胞與組織微環境的相互作用是驅動其分化為RTM的關鍵初始步驟。多胺-羥腐胺代謝軸作為一個細胞內在的調控節點。DHPS通過催化eIF5A羥脯氨酸化修飾,選擇性促進黏附分子與信號轉導相關mRNA的翻譯,從而驅動單核細胞向功能性組織駐留巨噬細胞(RTM)的分化及其在組織中的長期駐留。DHPS缺失導致RTM分化阻滯、導致巨噬細胞滯留在未充分分化的狀態。RTM存活率下降及穩態功能喪失,最終引發組織微環境失衡與慢性炎癥。該發現揭示了跨組織保守的RTM發育核心通路,不僅深化了對巨噬細胞命運決定機制的理解,也為理解巨噬細胞在組織健康、損傷修復及衰老(亞精胺改善衰老)相關疾病中的作用提供了新的視角。靶向DHPS/eIF5A翻譯調控軸干預免疫穩態相關疾病提供了新的治療靶點。
荷蘭Liposoma的巨噬細胞清除劑氯膦酸二鈉脂質體Clodronate Liposomes,氯膦酸鹽脂質體,廣泛被科研人員用于體內單核巨噬細胞清除。產品頻頻登刊Cell,Nature和Science,助力研究突破,拓展科學邊界。如需訂購,可以隨時聯系。技術支持可以聯系大中華辦事處靶點科技,專業技術團隊給您單核巨噬細胞清除提供整套解決方案。
原始文獻
Carrizo, G.E., Lin, P., Lee, S.H. et al. The transition from monocyte to tissue-resident macrophage requires DHPS. Nature (2026). doi.org/10.1038/s41586-025-09972-2